¿Qué es una reacción química?

Una reacción química es un proceso en el que una o más sustancias se transforman en otras sustancias diferentes. Por ejemplo, cuando quemamos un trozo de papel, el papel se convierte en ceniza, humo y gases. Estas sustancias son distintas al papel original, tanto en su aspecto como en sus propiedades. Decimos que el papel ha sufrido una reacción química.
¿Dónde se producen las reacciones químicas?
Las reacciones químicas ocurren constantemente a nuestro alrededor, tanto en la naturaleza como en los laboratorios. Algunos ejemplos de reacciones químicas naturales son:
- La fotosíntesis: es la reacción que realizan las plantas para obtener energía a partir de la luz solar, el agua y el dióxido de carbono.
- La respiración celular: es la reacción que realizan los seres vivos para obtener energía a partir del oxígeno y la glucosa.
- La digestión: es la reacción que ocurre en nuestro estómago e intestinos para descomponer los alimentos en nutrientes que nuestro cuerpo puede absorber.
- La oxidación: es la reacción que ocurre cuando una sustancia se combina con el oxígeno del aire. Por ejemplo, cuando el hierro se oxida y se forma el óxido de hierro, o cuando una manzana se pone marrón al cortarla.
Algunos ejemplos de reacciones químicas artificiales son:
- La combustión: es la reacción que ocurre cuando una sustancia arde en presencia de oxígeno. Por ejemplo, cuando encendemos una vela o un fósforo.
- La síntesis: es la reacción que ocurre cuando combinamos dos o más sustancias para obtener una nueva sustancia. Por ejemplo, cuando mezclamos bicarbonato de sodio y vinagre y se forma dióxido de carbono.
- La descomposición: es la reacción que ocurre cuando una sustancia se divide en otras sustancias más simples. Por ejemplo, cuando aplicamos electricidad al agua y se forma hidrógeno y oxígeno.

¿Qué son los reactivos y los productos?
Los reactivos son las sustancias que participan en una reacción química y que se consumen o modifican durante la misma. Los productos son las sustancias que se forman como resultado de una reacción química. Por ejemplo, en la reacción de combustión del metano (un gas natural), tenemos:
Al quemar una molécula de metano se une a dos de oxígeno y resulta en una molécula de dióxido de carbono (lo mismo que exhalamos al respirar) y dos moléculas de agua. Veamos la reacción.
CH4 + 2 O2 → CO2 + 2 H2O
En esta ecuación, CH4 (el metano) y O2 (el oxígeno) son los reactivos, CO2 (dióxido de carbono) y H2O (agua) son los productos. Si te fijas, antes y después de la reacción se siguen manteniendo el número de átomos. Antes y después tienes: un átomo de carbono, cuatro de hidrógeno y cuatro de oxígeno.
Velocidad de reacción
La velocidad de reacción es la medida de cuánto tiempo tarda una reacción química en completarse. Depende de varios factores, como la temperatura, la concentración, la superficie de contacto, la presencia de luz o la agitación. Por lo general, cuanto mayor sea la temperatura, la concentración o la superficie de contacto, o cuanto más se agite o ilumine la mezcla, mayor será la velocidad de reacción.
Tipos de reacciones
Existen muchos tipos de reacciones químicas, según el tipo de cambio que se produzca. Algunos ejemplos son:
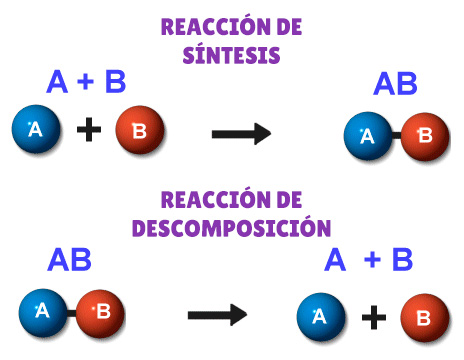
- Reacciones de síntesis: son aquellas en las que dos o más sustancias se combinan para formar una sola. Por ejemplo, la fotosíntesis es una reacción de síntesis en la que las plantas usan dióxido de carbono y agua para producir glucosa y oxígeno.
- Reacciones de descomposición: son aquellas en las que una sustancia se divide en dos o más. Por ejemplo, la electrólisis del agua es una reacción de descomposición en la que el agua se separa en hidrógeno y oxígeno mediante una corriente eléctrica.
- Reacciones de sustitución: son aquellas en las que un átomo o grupo de átomos de una sustancia es reemplazado por otro. Por ejemplo, el hierro se oxida al reaccionar con el oxígeno del aire y forma óxido de hierro.
- Reacciones de doble sustitución: son aquellas en las que dos sustancias intercambian sus átomos o grupos de átomos. Por ejemplo, al mezclar cloruro de sodio (sal) y nitrato de plata se forma cloruro de plata y nitrato de sodio.
Catalizadores e inhibidores
Los catalizadores son sustancias que aceleran la velocidad de una reacción química sin consumirse ni modificarse durante la misma. Los inhibidores son sustancias que disminuyen la velocidad de una reacción química sin consumirse ni modificarse durante la misma. Por ejemplo, las enzimas son catalizadores biológicos que facilitan las reacciones químicas que ocurren en los seres vivos. El ácido ascórbico (vitamina C) es un inhibidor que evita que las frutas se pongan marrones al oxidarse, por eso también se usa como conservante.
Datos interesantes sobre las reacciones químicas
- Cuando el hielo se funde, pasa por una transformación física de estado sólido a líquido. A pesar de este cambio, no ocurre ninguna reacción química, ya que la sustancia sigue siendo la misma: agua (H2O).
- La vida es el resultado de miles de millones de reacciones químicas que ocurren constantemente en las células.
- El fuego es una reacción química exotérmica, es decir, que libera energía en forma de calor y luz.
- El ácido sulfúrico es uno de los productos químicos más utilizados en la industria y se obtiene mediante una serie de reacciones químicas a partir del azufre, el aire y el agua.
- El amoníaco es una sustancia que se forma por la reacción química entre el nitrógeno y el hidrógeno. Se usa como fertilizante, limpiador y refrigerante.
- El ácido acético es el principal componente del vinagre y se produce por la fermentación del alcohol etílico hecha por las bacterias.



